"마침내 치매 치료제 나왔다"…알츠하이머 신약 첫 승인
미국 식품의약국(FDA)은 7일(현지시간) 미국 제약사 바이오젠과 일본 에자이가 공동 개발한 알츠하이머 치료제 ‘애드유헬름(Aduhelm, 성분명 아두카누맙)’을 승인했다. AP=연합뉴스
알츠하이머 치매를 정복하기 위한 인류의 첫걸음이 시작됐다. 미국 식품의약국(FDA)은 7일(현지시간) 미국 제약사 바이오젠과 일본 에자이가 공동 개발한 알츠하이머 치료제 ‘애드유헬름(Aduhelm, 성분명은 아두카누맙)’을 승인했다. 다만 미국 내 일부 전문가가 "효능이 제대로 입증되지 않았다"고 비판하고 있어 논란이 이어지고 있다. FDA는 이를 의식해 바이오젠에 시판 후 약 효능 검증을 위한 후속 연구를 하도록 지시했다. 소위 '4상 임상시험'이다. 바이오젠이 후속 연구에서 효능을 입증하지 못하면 승인이 철회될 수 있다.
미국 FDA 알츠하이머 치료제 승인
전문가 "굉장히 기다리던 약" 환영
일부선 "약효 입증 더 지켜봐야"
국내 치매 전문가들은 크게 환영한다. 조한나 강남세브란스 신경과 교수는 "치매 치료제가 나온 것은 처음이다. 획기적인 일"이라고 말했다. 김기웅 분당서울대병원 정신건강의학과 교수는 "알츠하이머 치매 치료 20년 만에 획기적인 전환점을 맞았다"고 말했다. 한설희 건국대병원 신경과 교수는 "치료에 서광이 비추기 시작했다"고 평가했다.
애드유헬름은 알츠하이머병의 원인이 되는, 뇌의 해로운 단백질 덩어리인 아밀로이드 베타 단백질(amyloid beta protein)을 제거하는 역할을 한다. 한설희 교수는 "그동안 알츠하이머병 치료제로 사용돼온 약은 병의 증상을 일시적으로 개선하거나 완화하는 ‘대증 치료제’이며 이번 신약은 차원이 다른 약"이라고 평가했다. 한 교수는 "이번 신약은 알츠하이머병의 발생 원인이며 증상 악화에 관여하는 불용성 단백질인 아밀로이드베타단백질을 뇌 조직 내에서 효과적으로 제거한다"며 "병의 진행을 억제하거나 근원적으로 병의 발생을 차단할 수 있는 ‘원인 치료제’라는 점에서 신기원을 이룩한 것"이라고 덧붙였다. 로이터통신은 이날 기존 치료제는 불안·불면증 같은 증상을 관리하는 데 그쳤기 때문에 알츠하이머를 근본적으로 치료하기 위한 신약이 승인된 것은 이번이 처음이라고 전했다. 환자들은 이 약을 4주에 한 번씩 주사 맞아야 한다.
중앙치매센터에 따르면 국내 65세 이상 노인 치매 추정환자는 75만488명(2018년 기준)이다. 노인 인구의 10.2%가 치매를 앓고 있다. 2024년 100만명, 2039년 200만명, 2050년 300만명으로 늘어난다. 치료비로 2조5000억원, 노인장기요양보험에서 케어 비용으로 4조원이 들어가는 등 연간 15조3000억원(국내총생산의 0.8%)이 투입된다. 중앙치매센터는 세계 치매 인구를 약 5000만명으로 추정한다(알츠하이머병 인터녀셔널 자료).

미국 제약사 바이오젠의 연구원이 매사추세츠주 캠브리지의 바이오젠 본사 연구소에서 일하고 있다. AP=연합뉴스
김희진 삼성서울병원 신경과 교수는 "알츠하이머는 아밀로이드가 쌓이고 이어 타우 단밸질이 쌓여서 신경세포가 변한다. 아밀로이드는 트리거(방아쇠) 역할을 하는 단백질이다. 이번 신약이 아밀로이드를 없앤다. 예전 치료제와 완전히 다른 약으로 치매 환자나 보호자들이 굉장히 기다리던 약"이라고 말했다.
이 약은 치매가 상당히 진행된 환자에게는 쓰지 못하는 것으로 알려져 있다. 한설희 교수는 "신약은 치매 중에서도 알츠하이머 치매만 해당한다(알콜성 치매 등에는 해당하지 않는다는 뜻). 또 초기 치매나 경도인지장애 환자에만 효과가 있다. 이미 상당히 진행된 중증 환자는 효과를 보기 어렵다"고 말했다. 경도인지장애는 치매 전 단계 환자를 말하는데, 이들에게 신약을 사용해 치매가 생기지 않게 할 수 있다는 것이다. 분당서울대 김기웅 교수는 "기존 약물들은 증상 악화를 지연시키는 기능을 하는데, 이번 신약이 상호보완적으로 작용할 수 있다는 점에서 의미가 있다"고 말했다.
아직 갈길이 많이 남았다. 한설희 교수는 "알츠하이머 환자 뇌 안에는 아밀로이드 단백질 말고, 신경섬유원다발이라는 신경세포 독성 물질이 있는데, 이를 제거하는 약이 나와야 완전한 알츠하이머 정복이라고 할 수 있다"고 말했다. 한 교수는 "이번 신약이 알츠하이버병 치료의 게임 체인저(판세를 바꾸는 것)로 등장한 것은 사실이나 아직은 절반의 성공"이라고 말했다.
이 약은 논란 끝에 승인돼 효능에 의문이 제기된다. 지난해 11월 FDA의 외부 전문가 자문위원회는 이 약의 유효성을 입증할 데이터가 부족하다고 판단해 승인을 권고하지 않았다. 지난해 3상 임상시험에선 두 건의 연구 결과가 서로 상충하자 시험을 중단한 적이 있다. 이후 두건의 임상 결과 중 고용량 투약 결과만 따로 분석했더니 상당한 효과가 있는 것으로 나왔다. FDA는 자문위원회의 권고와 달리 조건부 승인했다. 애드유헬름이 기억력·인지능력 등을 되돌리지는 못하고 쇠퇴를 늦추는 정도의 효과가 있다는 지적도 나온다. AP통신은 "환자나 가족들은 새로운 치료법이 작은 효능이라도 있다고 판단되면 승인해야 한다고 요구하는 반면 전문가들은 효과가 의심스러운 치료법을 승인하는 것은 위험한 선례를 남길 수 있다며 경계해왔다"고 전했다.
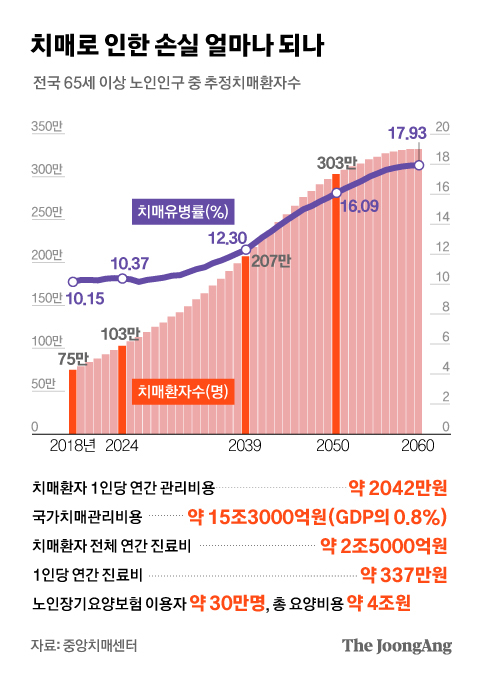
치매로 인한 손실 얼마나 되나. 그래픽=박경민 기자 minn@joongang.co.kr
부작용 우려도 있다. 한설희 교수는 "이 약을 투여하면 아밀로이드가 일시에 제거되면서 미세한 뇌혈관을 손상시키는 부작용이 드물게 나타날 수 있다. 자기공명영상(MRI)을 촬영하면서 이런 증세가 보이면 투약을 중단해야 한다"고 말했다. 김희진 교수도 "뇌부종같은 부작용이 생길 가능성이 있다"고 말했다.
비싼 가격도 문제다. 바이오젠은 애드유헬름의 가격을 연간 5만6000달러(약 6230만원)로 책정했다고 밝혔다. 이는 전문가들이 예상했던 연간 1만~2만5000달러(약 1115만~2788만원)보다 두 배 이상 높다. 김희진 교수는 "약값이 너무 비쌀 것 같아서 걱정"이라고 말했다.
바이오젠은 미국·독일·프랑스·호주·일본·대만을 비롯해 세계 20개국 348개 병원에서 3285명을 대상으로 임상 3상시험을 했다. 한국 환자도 100명가량 참여했다. 이 약이 국내로 들어오는 데는 시간이 걸릴 전망이다. 식품의약품안전처 시판 허가를 받아야 하고, 건강보험 적용할지, 적용할 경우 얼마로 할지 등의 복잡한 절차를 거쳐야 한다. 약가 협상에도 상당한 시간이 걸린다. 식약처 관계자는 "국내에서 임상시험을 할지 여부는 지금 판단하기 이르다"고 말했다.
신성식 복지전문기자, 이에스더·정영교 기자 ssshin@joongang.co.kr
[출처: 중앙일보] "마침내 치매 치료제 나왔다"…알츠하이머 신약 첫 승인





